清华施一公研究组发文报道人体γ-分泌酶与重要底物Notch和APP复合物的高分辨率三维结构
时间:2019-01-15 16:23:52
清华新闻网1月11日电 2018年12月31日和2019年1月10日,施一公教授领导的研究团队在《自然》(Nature)和《科学》(Science)分别发表了《人源γ-分泌酶识别底物Notch的结构机制》(Structural basis of Notch recognition by human γ-secretase)和《人源γ-分泌酶底物淀粉样前体蛋白的识别》(Recognition of amyloid precursor protein by human γ-secretase)的文章,分别报道了分辨率为2.7埃的人体γ-分泌酶结合底物Notch以及分辨率为2.6埃的γ-分泌酶结合淀粉样前体蛋白(APP)的冷冻电镜结构。文章报道了结合两种不同底物后γ-分泌酶发生的构象变化,并对这些构象变化的功能进行了生化研究。上述两篇文章为理解γ-分泌酶特异性识别并切割底物的分子机制提供了重要基础,同时为研究与癌症以及阿尔兹海默症相关的药物提供了重要的结构信息。
阿尔兹海默症(Alzheimer’s disease, AD)是当今世界面临的最为严峻的神经退行性疾病。临床表现为脑组织切片中出现淀粉样斑块,神经元死亡,认知和记忆能力受损,最后脑功能严重受损直至死亡。统计结果表明,在65岁以上人群中,其发病率高达10%,在85岁以上人群中,发病率更是达到30-50%;我国目前患该病的人口高达500万,约占世界患者总数的四分之一,并且由于世界范围内预防治疗手段不足,缺乏特效药物,该疾病有发病年龄提前,发病人数增加的趋势,给病人及家属造成极大痛苦,也同时为社会带来沉重负担。
阿尔兹海默症的发病机理尚不明确。病人脑组织中的淀粉样斑块由淀粉样蛋白前体蛋白(APP, amyloid precursor protein)被酶切割产生的短肽聚集而来。在此切割过程中,最关键的蛋白酶是γ-分泌酶(γ-secretase)。γ-分泌酶由四个跨膜蛋白亚基组成,分别为Presenilin(PS1)、Pen-2、Aph-1和Nicastrin。其中,编码PS1蛋白的基因中有200多个突变与AD病人相关,而PS1正是行使酶切功能的关键活性亚基。这些突变有可能导致PS1功能异常而引起阿尔兹海默症的发生。γ-分泌酶在阿尔兹海默症的发病中扮演着重要角色,很多药物的研发直接以γ-分泌酶作为靶点,希望通过调节其活性来治疗疾病。此外,除淀粉样蛋白外,重要的信号蛋白Notch也是γ-分泌酶的底物。Notch的异常切割会导致发育的异常,与一些诸如T细胞急性淋巴细胞白血病在内的癌症发病也有重要联系。作为与阿尔兹海默症和癌症均紧密相关的蛋白,γ-分泌酶结构的解析与功能的研究一直是重要的科学问题。
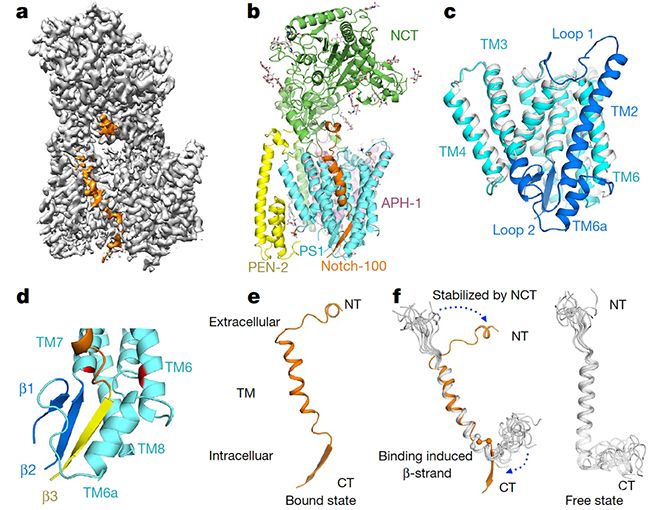
图1: γ-分泌酶结合Notch复合物的冷冻电镜结构。a. γ-分泌酶结合Notch复合物的密度图。其中橙色标记的为结合的Notch;b. γ-分泌酶结合Notch复合物结构模型;c. 底物结合与不结合状态下催化亚基PS1的结构比较,灰白色为未结合底物的状态,青色和蓝色为结合底物的状态,蓝色部分为发生变化的主要区域; d. PS1与底物跨膜区靠近细胞膜一侧形成β折叠片,从而稳定结合底物;e-f. 与γ-分泌酶结合后底物Notch发生的构象变化。橙色为结合在γ-分泌酶中的Notch构象,灰白色为未结合的构象。
施一公教授2006年在清华大学建设实验室之初,就将揭示阿尔兹海默症的发病机理作为重点研究方向,其中一个主要环节是解析γ-分泌酶的高分辨率结构,揭示Presenilin突变体的致病机理。他们经过长期不懈的努力,积累了丰富的经验和大量数据,先后于近几年取得一系列重要突破。此次两篇文章报道的研究成果是此前施一公研究组对γ-分泌酶结构与功能系统研究不断深入的延续。
如前文所述,尽管施一公研究组已经解析了γ-分泌酶的高分辨率结构,但其如何与底物结合尚不清楚。近年来,多种旨在减少淀粉样沉淀的γ-分泌酶活性抑制剂的临床实验均宣告失败,较为著名的是礼来公司临床实验的Semagacestat。这一抑制剂虽然能够减少淀粉样沉淀,但并不能改善患者的认知状况,更严重的是由于同时抑制了γ-分泌酶对Notch的切割,使得患者罹患癌症的风险大幅增加,最终该临床实验提前终止。究其原因,对γ-分泌酶结合底物机制研究的缺失是造成这一失败的原因之一。基于此,获得γ-分泌酶与底物Notch以及APP复合物的结构,对研究γ-分泌酶的底物识别酶切机理,和以γ-分泌酶为靶标的特异性药物设计具有极大科学意义和潜在应用价值。
由于酶与底物的结合-酶切-解离的过程是高度动态的过程,获得酶与底物的复合物结构难度非常大,而γ-分泌酶与其底物都是跨膜蛋白,获得它们的稳定复合物是世界级难题。施一公课题组通过严谨的设计和筛选,通过半胱氨酸交联的办法,首先成功获得了γ-分泌酶与底物Notch的稳定复合物。通过收集冷冻电镜的数据,他们解析了γ-分泌酶与底物Notch的复合物结构,分辨率高达2.7埃,是第一个γ-分泌酶与底物复合物的高分辨率结构,也是第一个膜内蛋白水解酶与底物的复合物结构。之后他们基于不同底物蛋白质序列及结构比对,利用相似的策略,顺利获得了γ-分泌酶与另一个重要底物底物APP的稳定复合物,并获得了其冷冻电镜结构。
关键字: